QUÍMICA DECO RESUELTA
PREGUNTA 89 :
Muchas reacciones químicas son de tipo redox (implican transferencia de electrones). Tal es el caso de la siguiente reacción química:
HNO3(ac)+H2S(ac)→NO(g)+S(s)+H2O(ℓ)
Al respecto, determine el valor de verdad (V o F) de las siguientes proposiciones:
I. El coeficiente del agente oxidante es 3 y el del agente reductor es 2.
II. Se transfieren 2 moles de electrones por cada mol de agente reductor.
III. Al formarse 8 moles de H2O, se producen 4 moles de la forma reducida.
A) VVV
B) VFF
C) FFV
D) FVV
E) VVF
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 90 :
Todos los cambios de fase están asociados a un cambio de energía, pues son procesos isotérmicos. Considerando, en el caso del agua, un calor de vaporización igual a 40,7 kJ/mol, determine la energía en kJ, que absorben 900 mililitros de agua líquida a 100 °C para pasar a vapor (100 °C).
Datos: Densidad del agua =1 g/mL
Peso fórmula H2O= 18 g/mol
A) 2,035×103
B) 1,017×103
C) 2,035×106
D) 2,035×105
E) 1,017×104
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 91 :
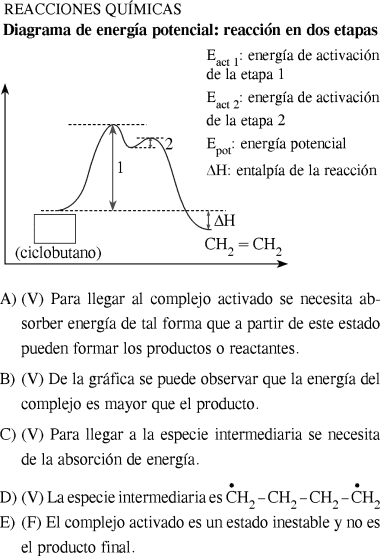
La conversión del ciclobutano en eteno o etileno ocurre en dos etapas, es de carácter exotérmico y ha sido estudiada por la femtoquímica.
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 92 :
Se dispone de 200 mililitros de hidróxido de potasio 0,1 M y se desea llevarlo a un pH neutro utilizando ácido sulfúrico 0,5 M (considere base y ácido fuerte respectivamente). Al respecto, determine el valor de verdad (V o F) de las siguientes proposiciones:
I. Están presentes 0,02 equivalentes de la base (KOH).
II. Para lograr el objetivo se necesita 20 mililitros de ácido.
III. La reacción genera una sal oxisal conocida como sulfito de potasio.
A) FFV
B) FVF
C) VVF
D) VFF
E) VVV
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 93 :
Las reacciones químicas orgánicas pueden realizarse por diferentes mecanismos. Se presenta una molécula a la que se somete a hidrogenación para obtener un compuesto insaturado.
Ecuación química:
Al respecto, establezca la alternativa incorrecta.
A) Se necesita 2,4×1025 átomos de hidrógeno para saturar 10 moles de reactante.
B) La reacción es de adición e implica la ruptura del enlace pi (𝛑).
C) La fórmula global del alifático saturado es C8H18 y su nombre es etilciclohexano.
D) En el reactante, se observa 4 carbonos lineales y planos.
E) El producto formado presenta un total de 6 carbonos secundarios.
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 94 :
Una reacción química orgánica es la esterificación; por medio de ella se obtienen ésteres a partir de ácidos orgánicos y alcoholes o de fenoles.
Al respecto, determine el valor de verdad (V o F) de las siguientes proposiciones:
I. En la estructura del ácido, el cloro está en posición meta.
II. Para formar el éster, se rompe el enlace O–H del grupo carboxilo.
III. El nombre del éster formado es 3-clorobenzoato de bencilo.
A) VVF
B) FFV
C) VFF
D) VFV
E) VVV
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 95 :
Se calienta dos moles de sulfato de cobre pentahidratado con ayuda de un mechero de Bunsen para eliminar completamente el agua. Ecuación química:
CuSO4·5H2O(s)+ calor → CuSO4(s)+ 5H2O(g)
Al respecto, determine el valor de verdad (V o F) de las siguientes proposiciones:
I. El número de iones sulfato presente en la masa de sal es 1,2×1025.
II. La masa final de la sal anhidra es de 319 gramos.
III. A condiciones normales, el agua desprendida ocuparía 2,24×102 litros.
Datos: H=1 g/mol, O=16 g/mol, S=32 g/mol, Cu=63,5 g/mol
A) VVV
B) FVV
C) VFV
D) FFV
E) FVF
Rpta. : "A"
SEGUNDA PRUEBA
PREGUNTA 89 :
La representación Lewis de una molécula es aquella donde, alrededor de cada átomo, se indican los electrones que forman los enlaces. Identifique aquella molécula cuyo átomo central posee dos pares de electrones libres.
Datos:
Elemento H C O N S Cl
Z 1 6 8 7 16 17
A) CH₂Cl₂
B) CO₂
C) NH₃
D) H₂S
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 90 :
Los compuestos binarios formados por la combinación de un elemento y el oxígeno reciben el nombres de óxidos. Identifique el nombre del Cl₂O₃ en la nomenclatura STOCK.
A) Trióxido de dicloro
B) Óxido de cloro (III)
C) Óxido cloroso
D) Óxido clórico
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 91 :
La masa molar de un ácido graso poliinsaturado es 280 g/mol y tiene la siguiente composición porcentual: C=77,14%, H=11,43% y O=11,43%. Identifique la alternativa que corresponda a su fórmula empírica y a su fórmula molecular, respectivamente.
Datos:
Elemento H C O
uma 1 12 16
A) C₉H₃₂O y C₁₈H₆₄O₂
B) C₉H₈O y C₁₈H₁₆O₃
C) C₉H₁₆O y C₁₈H₃₂O₂
D) C₉H₈O y C₁₈H₁₆O₂
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 92 :
De acuerdo con la teoría de las colisiones, la velocidad de una reacción es proporcional a número de colisiones por segundo. Los factores que favorecen un mayor número de choques aceleran la velocidad de las reacciones. Identifique las condiciones que favorezcan el aumento de la velocidad en la siguiente reacción:
2KClO₃(s) + Calor → 2KCl(s) + 3O₂(g)
I. Pulverización de la muestra de KClO₃
II. Adición de un catalizador.
III. Disminución de la temperatura
A) Solo I y II
B) I, II y III
C) Solo II y III
D) Solo I y III
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 93 :
Tomando como base la combinación de orbitales atómicos, Linus Pauling propuso en 1931, por primera vez, el concepto de orbitales atómicos híbridos o mixtos. Indique la afirmación correcta respecto de estos orbitales.
A) Cada uno de los cuatro orbitales híbrido sp³ tiene diferente energía.
B) Los átomos de carbono de la molécula de etileno tienen hibridación sp.
C) Al combinarse un orbital s y un p, se forman dos orbitales híbridos sp.
D) Los orbitales híbridos sp² se forman al combinar el orbital s y un orbital p.
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 94 :
La concentración de iones hidrógeno [H+] del agua pura a 25°C es 1 × 10−⁷ M. Dado que [H+] y [OH–] son cantidades muy pequeñas para expresar la acidez o basicidad de una solución, Sorensen propuso una escala de pH en función de la concentración de la solución y la definió como pH=–log[H+]. Seleccione la afirmación correcta entre las siguientes alternativas.
A) Cuando el valor del pH de una solución es 3, tiene una (H+) = 1 × 10³ M.
B) Una solución con pH 3 es 10 veces más ácida que una solución con pH 4.
C) A medida que disminuye la concentración de hidrógeno, el pH disminuye.
D) Cuanto más alto es le valor del pH de una solución, su acidez será mayor.
RESOLUCIÓN :
Rpta. : "B"