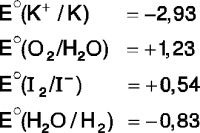SIMULACRO DE QUÍMICA UNI DESARROLLADO PRUEBA DE ENSAYO DE EXAMEN ADMISIÓN UNIVERSIDAD DE INGENIERÍA PDF
PREGUNTA 1 :
Indique el grupo y periodo de la tabla periódica, respectivamente, correspondiente a un elemento químico cuya configuración electrónica termina en
A) IA ; 4
B) IIIA ; 3
C) VA ; 4
D) VIIIB ; 3
E) IB ; 4
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 2 :
En los siguientes oxianiones, indique el que está correctamente nombrado.
RESOLUCIÓN :
NOMENCLATURA INORGÁNICA
De los radicales presentados observamos el bromo que presenta
+1 hipo...oso
+3 ...oso
+5 ...ico
+7 per...ico
Luego, ácido hipobromoso (HBrO), de donde el radical hipobromito será BrO–.
Rpta. : "D"
PREGUNTA 3 :
Respecto al recurso agua, ¿cuáles de las siguientes proposiciones son correctas?
I. El agua nunca se encuentra pura en la naturaleza, debido a la facultad que tiene para disolver o dispersar diferentes sustancias.
II. El agua de lluvia recolectada, en la azotea de una vivienda, en un recipiente esterilizado, es agua pura.
III. La contaminación de las aguas con materia orgánica biodegradable disminuye la concentración de oxígeno disuelto.
A) solo I
B) solo II
C) solo III
D) I y III
E) I, II y III
RESOLUCIÓN :
TEMA : Contaminación ambiental
Analizaremos cada afirmación:
I. El agua nunca se encuentra pura en la naturaleza, debido a la facultad que tiene para disolver o dispersar diferentes sustancias.
Correcta, el agua se encuentra en la naturaleza formando los océanos, mares, ríos, etc.
II. El agua de lluvia recolectada en la azotea de una vivienda, en un recipiente esterilizado, es agua pura.
Incorrecta, el agua de lluvia es una mezcla, cuyo pH es ácida, debido a la presencia de ácido nítrico, ácido sulfúrico y ácido sulfuroso, que se forman al reaccionar, el agua (presente en la humedad del aire) con óxido de nitrógeno, dióxido de azufre y trióxido de azufre, los cuales son emitidos por las fábricas, vehículos, etc.
III. La contaminación de las aguas con materia orgánica biodegradable disminuye la concentración de oxígeno disuelto.
Correcta, la disminución de oxígeno ocurre al momento del proceso de degradación de la materia biodegradable.
Rpta. : "D"
PREGUNTA 4 :
Señale la alternativa que presenta la secuencia correcta, después de determinar si la proposición es verdadera (V) o falsa (F):
I. El número máximo de orbitales atómicos correspondientes al tercer nivel de energía es nueve.
II. Un orbital atómico tipo p presenta forma tetralobular.
III. El orbital atómico 7pz presenta mayor tamaño que el orbital atómico 6pz.
A) VFV
B) VFF
C) FVV
D) VVV
E) FFF
RESOLUCIÓN :
Tema: Números cuánticos
Los números cuánticos, según la resolución de la ecuación de onda de E. Schrödinger, describe las características de los estados de energía: niveles, subniveles y orbitales. Analicemos cada proposición.
I. Verdadera
El número de orbitales como máximo en un nivel n es igual a n².
Si n = 3 → 3²= 9 orbitales
II. Falsa
El orbital atómico tipo p tiene forma dilobular.
III. Verdadera
El número cuántico principal (n) determina el tamaño o volumen del orbital atómico.
El orbital 7pz (n = 7) tiene mayor tamaño que 6pz (n = 6).
Rpta. : "A"
PREGUNTA 5 :
Una de las preocupaciones a nivel mundial es el calentamiento global originado por las actividades del hombre.
Al respecto, señale la alternativa que presenta la secuencia correcta después de determinar si las proposiciones son verdaderas (V) o falsas (F).
I. El calentamiento global es consecuencia del aumento de la temperatura en la atmósfera terrestre.
II. El cambio climático que ocurre en la Tierra está relacionado principalmente al impacto de los gases de efecto invernadero.
III. El término efecto invernadero se refiere a la retención del calor en la atmósfera por parte de una capa de gases en la atmósfera, como por ejemplo el dióxido de carbono, el vapor de agua y metano.
A) VVV
B) VFV
C) VFF
D) FFV
E) FFF
RESOLUCIÓN :
El efecto invernadero es un fenómeno natural, en donde la luz solar que atraviesa la atmósfera se absorbe y calienta la superficie de la tierra. La superficie caliente emite radiación infrarroja (calor) que es absorbida por el metano, vapor de agua y CO2, principalmente, y es retenido en la atmósfera produciendo un efecto de calentamiento y como consecuencia, cambios en el clima.
Este fenómeno natural es crucial para mantener la adecuada temperatura en la tierra, sin él la tierra estaría cubierta de hielo permanentemente. Sin embargo, el contenido de estos gases en los últimos tiempos, ha incrementado considerable- mente, especialmente el CO2, debido a la combustión y a la deforestación de las zonas tropicales. Ocasionando un aumento en la temperatura media de la tierra, provocando calentamiento global.
Analizamos las proposiciones
I. Verdadera
A mayor temperatura de la atmósfera del planeta, se origina calentamiento global.
II. Verdadera
Los gases de efecto invernadero incrementan la temperatura de la Tierra.
III. Verdadera
El CO2, CH4 y H2O retienen el calor que debió salir del planeta.
Rpta. : "A"
PREGUNTA 7 :
La corrosión de un metal es un proceso espontáneo a temperatura ambiente.
Al respecto, ¿cuáles de las siguientes proposiciones son correctas?
I. La corrosión implica un proceso de oxidación reducción.
II. En algunos casos, la corrosión del metal forma una capa protectora que disminuye el proceso de corrosión.
III. El daño estructural por efectos de la corrosión tiene una alta repercusión económica.
A) solo I
B) I y III
C) solo III
D) I y II
E) I, II y III
RESOLUCIÓN :
TEMA : Electroquímica
La corrosión se define como el deterioro de un material a consecuencia de un ataque electroquímico por parte de su entorno. De manera más general, puede entenderse como la tendencia general que tienen los materiales a buscar su forma más estable.
La velocidad a la que tiene lugar la corrosión dependerá en alguna medida de la temperatura y la salinidad, y de la concentración del fluido en contacto con el metal.
Analizaremos cada afirmación
I. La corrosión implica un proceso de óxido- reducción.
Es correcto, la corrosión es un proceso redox, por el cual los metales se oxidan con O2 en presencia de humedad.
II. En algunos casos, la corrosión del metal forma una capa protectora que disminuye el proceso de corrosión.
Es correcta, existen varios métodos para proteger metales en contra de la corrosión y uno de ellos es hacer que forme de manera natural una película protectora, tal como óxido metálico, sobre la superficie del metal.
III. El daño estructural por efectos de la corrosión tiene una alta repercusión económica.
Es correcta, a la corrosión se debe la pérdida anual de mucho dinero en productos metálicos.
Rpta. : "E"
PREGUNTA 8 :
La sanguina seca (pintura roja) contiene, como pigmento, aproximadamente el 63 % en masa de óxido férrico, ¿cuántos mililitros de ácido clorhídrico 2 M se requieren para que todo el pigmento contenido en 10 g de sanguina reacciones totalmente con el ácido?
A) 20
B) 40
C) 79
D) 118
E) 137
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 9 :
Una posible solución a la contaminación relacionada a los gases emanados por los motores de los autos es el uso de celdas de combustible H2-O2. Al respecto, ¿cuáles de las siguientes proposiciones son correctas?
I. En la celda se producen reacciones de oxidación-reducción.
II. La celda produce agua como producto.
III. La celda produce principalmente energía térmica.
A) I y II
B) I y III
C) II y III
D) solo II
E) solo III
RESOLUCIÓN :
La celda de combustible es un dispositivo que produce electricidad y agua, mediante un proceso inverso a la electrólisis.
Esta celda esta constituida por dos electrodos (ánodo y cátodo), un electrolito, H2 (combustible) y O2 (oxidante).
En el ánodo se produce la reacción de oxidación del combustible, generando electrones y protones, mientras que en el cátodo se produce la reacción de reducción del oxígeno.
Analizamos las proposiciones.
I. Correcta
Se producen dos reacciones:
• oxidación del hidrógeno (combustible)
• reducción del oxígeno (comburente)
II. Correcta
El H2O es el único producto.
III. Incorrecta
La principal energía liberada es la eléctrica.
Rpta. : "A"
PREGUNTA 10 :
Los elementos del grupo 17 de la tabla periódica moderna son conocidos como halógenos (“formadores de sales”). ¿Cuál de los siguientes compuestos corresponde a una sal de un halógeno?
A) NH4NO3
B) K2S
C) NaCl
D) Mg3N2
E) Br2
RESOLUCIÓN :
Los elementos del grupo 17 o VIIA son conocidos como halógenos (F, Cl, Br, I) porque tienen la capacidad para formar sales.
Analizamos las alternativas propuestas.
A) No corresponde.
El NH4NO3 es un oxisal que no contiene un halógeno.
B) No corresponde
El K2S es una sal haloidea, pero no contiene un halógeno.
C) Sí corresponde
El NaCl es una sal que contiene al cloro, que es un halógeno.
D) No corresponde
El Mg3N2 es una sal haloidea que no contiene un halógeno.
E) No corresponde
El Br2 es una sustancia simple.
Rpta. : "C"
PREGUNTA 11 :
Se tiene una mezcla de tetróxido de dinitrógeno y de dióxido de nitrógeno en equilibrio, a 0 ºC y 1 atm, de acuerdo a la reacción
Si en esas condiciones la presión parcial del N2O4(g) es 0,8 atm, determine el valor de la constante Kc.
A) 2,2×10^– 3
B) 1,1×10^– 2
C) 5,0×10^– 2
D) 2,5×10^– 1
E) 5,0×10^– 1
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 12 :
Dada la siguiente tabla de constantes de ionización ácida a 25 ºC
¿Cuáles de las siguientes proposiciones son correctas?
I. Al HBrO le corresponde la base conjugada más estable.
II. HClO2 es el ácido más reactivo.
III. La base conjugada de HN3 es N^–3 y es la base conjugada más débil.
A) solo I
B) solo II
C) solo III
D) I y II
E) I, II y III
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 13 :
Se tiene un pequeño volumen de cierta muestra líquida y se determina su densidad mediante un método sencillo. Para esto se midió la masa de un vaso de precipitado vacío y seco obteniéndose 12,074 gramos. Luego se vertió en el vaso 5,6 mL de la muestra líquida y la masa medida del vaso y el líquido contenido fue de 17,632 gramos. ¿Cuál es la densidad de la muestra líquida? (kg/m³)
A) 8,83×10²
B) 9,93×10²
C) 1,04×10³
D) 2,09×10³
E) 3,06×10³
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 14 :
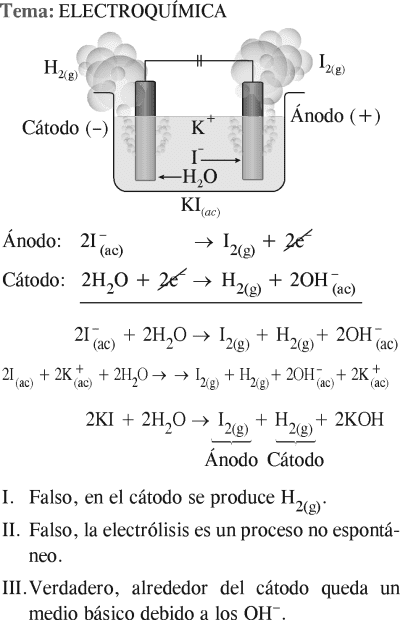
Dadas las siguientes proposiciones con respecto a la electrólisis de una solución de ioduro de potasio (KI), ¿cuáles son correctas?
I. Se produce iodo (I2) en el cátodo.
II. La reacción se lleva a cabo de manera espontánea.
III. La solución que rodea al cátodo cambia a fucsia con la adición de fenolftaleína.
Potencial estándar de reducción (V)
A) solo I
B) solo II
C) solo III
D) I y III
E) I, II y III
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 15 :
¿Cuáles de las siguientes moléculas presentan momento dipolar nulo?
A) solo I
B) solo II
C) solo III
D II y III
E) I, II y III
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 16 :
Un recipiente rígido contiene 1000 litros de gas metano (CH4) a 0 °C y una atmósfera. Si se libera el gas hasta que su presión disminuye a la mitad de su valor inicial, manteniendo la misma temperatura, ¿cuántos gramos de metano quedarán en el balón? R=0,082 atm· L/mol K Masas atómicas: H = 1, C =12
A) 22,3
B) 44,6
C) 357,2
D) 714,5
E) 1429,4
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 17 :
Un estudiante analiza los potenciales de reducción del aluminio y hierro:
De su análisis deduce que el aluminio debería corroerse más fácilmente que el hierro y, siendo así, una lata hecha de aluminio con gaseosa debería corroerse más rápidamente. Por lo tanto, las latas de gaseosa deberían hacerse de hierro. Sin embargo, esto no ocurre así. ¿Cuál es la razón por la cual ese proceso de corrosión no se observa en las latas de aluminio?
A) Debido a la capa de óxido de aluminio (Al2O3) que se forma en la superficie del metal y lo protege.
B) El potencial de oxidación del aluminio es muy bajo.
C) El aluminio es pintado con alguna capa de barniz.
D) Se forma carbonato de aluminio insoluble. Al2(CO3)3, sobre el metal y lo protege.
E) El líquido de una gaseosa no es un medio corrosivo.
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 18 :
La lejía es una solución utilizada en la desinfección y como sacamanchas. Una lejía tiene una concentración al 5% en masa de hipoclorito de sodio (NaClO). Determine la molaridad (mol/L) de un galón de dicha lejía si tiene una densidad de 1,11 g/mL.
Masa molar (NaClO)= 74,5 g/mol
A) 0,74
B) 1,11
C) 1,48
D) 2,22
E) 2,96
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 19 :
La ionización del H₂S en medio acuoso se produce mediante las siguientes reacciones:
¿Cuál es la concentración molar (mol/L) de los iones H+ en una solución acuosa de H₂S 0,1 M?
A) 1,0× 10^– 3
B) 1,0× 10^– 4
C) 1,0× 10^– 5
D) 1,0× 10^– 6
E) 1,0× 10^– 7
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 20 :
¿Cuántos de los siguientes fenómenos presentados en las proposiciones son químicos?
I. Laminación del cobre
II. Oxidación del hierro
III. Evaporación del agua
IV. Fermentación de la uva
V. Disolución del azúcar en agua
A) 1
B) 2
C) 3
D) 4
E) 5
RESOLUCIÓN :
Un fenómeno químico, es un proceso por la cual la materia se transforma, perdiendo sus propiedades físicas y química, es decir, pierde sus propiedades, y origina nuevas sustancias con propiedades diferentes a las que dieron origen. Considerando esta premisa, analizaremos cada proposición:
I. LAMINACIÓN DEL COBRE
En el proceso de laminación del cobre, lo que se hace es reducir el espesor del cobre, manteniendo intacto las propiedades químicas, por lo tanto, no se trata de un fenómeno químico.
II. OXIDACIÓN DEL HIERRO
La oxidación es una reacción por la cual el hierro se convierte en un óxido (Fe2O3), transformándose en otra sustancia, por lo tanto, se trata de un fenómeno químico.
III. VAPORACIÓN DEL AGUA
La evaporación de agua es un fenómeno por el cual el agua sólo cambia de estado, por lo tanto no se trata de un fenómeno químico.
IV. FERMENTACIÓN DE LA UVA
En la fermentación de la uva ocurre reacciones en la que se producen sustancias como el etanol y el dióxido de carbono, por lo tanto, se trata de un fenómeno quí- mico.
V. DISOLUCIÓN DE AZÚCAR EN AGUA
El azúcar disuelta en agua no pierde sus propiedades, al igual que el agua, se les puede separar por procesos físicos sin que pierda sus propiedades originales, por lo tanto, no es un fenómeno químico.
Finalmente, son fenómenos químicos II y IV
Rpta. : "B"