QUÍMICA EXAMEN DESARROLLADO PRUEBA ADMISIÓN UNIVERSIDAD UNC CLAVES RESPUESTAS SOLUCIONES PREGUNTAS RESUELTAS PDF
PREGUNTA 1
De acuerdo a la configuración electrónica
₂₆Fe: [₁₈Ar] 4s²3d⁶
Determinar para el hierro el grupo al que pertenece.
A) IIA
B) VIB
C) VIIIA
D) VIA
E) VIIIB
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 2 :
¿Cuál de las siguientes alternativas expresa un ejemplo de una disolución verdadera?
A) Aire
B) Emulsión
C) Suspensión
D) Humo
E) Niebla
RESOLUCIÓN :
SOLUCIONES
Una disolución o solución es una mezcla homogénea en la que una sustancia (solvente) dispersa a otra sustancia (soluto) a nivel atómico, iónico, molecular.
Analizamos cada alternativa:
A) aire: mezcla homogénea
B) emulsión: mezcla heterogénea
C) suspensión: mezcla heterogénea
D) humo: mezcla heterogénea
E) niebla: mezcla heterogénea
Rpta. : "A"
PREGUNTA 3
¿Cuál de los siguientes iones está nombrado correctamente?
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 4 :
La relación temperatura - volumen de un gas fue investigado por:
A) Boyle
B) Avogadro
C) Pascal
D) Torricelli
E) Charles
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 5
¿Qué masa de HNO₃ se requiere para obtener 160 g de S?
Masas molares:
H= 1 g/mol
N= 14 g/mol
O= 16 g/mol
S= 32 g/mol
Ecuación:
2HNO₃+3H₂S → 2NO+3S+4H₂O
A) 220
B) 210
C) 320
D) 230
E) 260
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 6 :
El enunciado:
“Para una misma masa de un gas a una temperatura dada, siempre en producto de la presión por su volumen respectivo es constante”.
Corresponde a la:
A) Ley de las Isóbaras
B) Ley de las Isócoras
C) Ley de las Isotermas
D) Ley de Avogadro
E) Ley de Dalton
RESOLUCIÓN :
LEY DE LAS ISÓBARAS
«Si la presión de una masa gaseosa permanece constante. Los volúmenes y las temperaturas absolutas son proporcionales».
Se le llama proceso isobárico, también se le conoce tradicionalmente como la ley de las isóbaras o ley de Charles.
V₁/T₁= V₂/T₂
B) Falsa
LEY DE LAS ISÓCORAS
En un proceso donde se mantiene constante el volumen de una masa gaseosa, la presión varía directamente con la temperatura absoluta.
Se le llama proceso isométrico tradicionalmente ley de Gay Lussac o ley de las isócaras.
P₁/T₁= P₂/T₂
C) Verdadera
LEY DE LAS ISOTERMAS
«Si la temperatura de una masa gaseosa permanece constante, las presiones son inversamente proporcionales a los volúmenes ocupados por el gas».
Se le llama proceso isotérmico tradicionalmente ley de las isotermas o ley Robert Boyle y Edmond Mariotte.
D) Falsa
LEY DE AVOGADRO
Establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión.
V₁/n₁= V₂/n₂
E) Falsa
LEY DE DALTON
«Cuando se unen dos sustancias para formar otra diferente, donde el peso o masa de una de ellas permanece constante el peso total de la otra varia en números enteros y sencillos».
Rpta. : "C"
PREGUNTA 7 :
Determinar las sustancias en las que se descompone el compuesto KClO₃ cuando se le aplica calor.
Ecuación:
A) K₂O + KCl
B) KCl + O₂
C) Cl₂O₃ + K₂O
D) Cl₂O₃ + K
E) Cl₂ + K₂O
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 9 :
Se tiene tres isotopos cuyos números de masa son números consecutivos, si el promedio aritmético de sus números de masa es 16 y el isotopo más liviano posee siete neutrones, ¿Cuál será la suma de los neutrones de los otros dos?
A) 16
B) 17
C) 20
D) 15
E) 18
RESOLUCIÓN :
ISÓTOPOS O HÍLIDOS
Son átomos de un mismo elemento que tienen igual número atómico diferente número de masa y diferente número de neutrones.
Propiedades a
. Ocupan un mismo lugar en la tabla periódica debido a que tiene igual número atómico.
b. Tienen diferente número de neutrones.
c. Tienen la misma distribución electrónica, debido a que tienen igual número de electrones.
d. Tienen propiedades químicas similares, debido a que tienen igual número de electrones de valencia .
Rpta. : "B"
PREGUNTA 10 :
Un elemento presenta la siguiente configuración electrónica: [Ar] 4s²3d¹⁰4p⁵.
Indicar el período y el grupo del elemento.
A) 4 y VIIA
B) 4 y IIIA
C) 3 y VIIIA
D) 2 y VIIA
E) 3 y VIIA
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 11 :
Un gas se encuentra a ciertas condiciones iniciales. Si se aumenta su temperatura, se cumple que:
A) La presión disminuye
B) La densidad aumenta
C) El volumen disminuye
D) La presión es constante
E) La densidad disminuye
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 12 :
El valor de la constante de los Gases Ideales calculado a condiciones normales, según la Ecuación General de los gases Ideales, en las unidades , L.atm mol−¹.k−¹ es:
A) 0,820
B) 760
C) 22,4
D) 0,082
E) 8,20
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 13 :
Calcular el porcentaje de oxígeno, en masa, en un mol de metanol.
A) 60%
B) 40%
C) 80%
D) 50%
E) 75%
RESOLUCIÓN :
COMPOSICIÓN PORCENTUAL O CENTECIMAL
Es el porcentaje en masa correspondiente a cada uno de los elementos que lo forman.
Rpta. : "D"
PREGUNTA 15 :
Es el estado de alta energía en el que la materia se encuentra ionizada en forma de cationes y electrones libres, a muy altas temperaturas.
A) Estado sólido
B) Estado líquido
C) Estado gas
D) Estado plasma
E) Estado vapor
RESOLUCIÓN :
ESTADOS FÍSICOS DE LA MATERIA
Para indicar el número de estados de la materia podemos considerar dos criterios básicos, que son:
a) De acuerdo a la termodinámica se conoce como estado a aquel punto del cuerpo donde se define sus propiedades de presión, temperatura, volumen y entropía. Por consiguiente existen infinitos estados termodinámicamente.
b) Considerando las agrupaciones moleculares tendremos estados definidos:
1. Solido
2. Mesofase
3. Líquido
4. Gaseoso
5. Plasmático
6. Bose-Einstein
7. Supersólido
8. Jahn Teller
9. Líquido de espín cuántico
A) Falsa
Estado sólido
Es aquel donde predominan las fuerzas de atracción entre las partículas, éstas permanecen en posiciones definidas y apenas vibran alrededor de dicha posición, esta posición hace que los cuerpos sólidos sean rígidos con forma y volumen propios.
B) Falsa
Estado líquido
Son incompresibles, tienen volumen constante, no poseen forma definida, se difunden y se evaporan
C) Falsa
Estado gas
Los gases están constituidos de partículas tan pequeñas llamadas moléculas, y que el volumen real ocupado por dichas partículas es despreciable comparado con el espacio vació que hay entre ellas, y están dotadas de gran energía cinética.
D) Verdadera
Estado plasma
La materia ionizada (gasificada), se presenta como una mezcla formada por i
ones positivos, electrones y moléculas neutras con propiedades diferentes al gas primitivo. Este fenómeno se manifiesta en gran cantidad en el interior de las estrellas, cuyas estructuras oscilan entre 20 y 30 millones de °C.
Se caracteriza por poseer una carga de energía alta y buen conductor de electricidad.
E) Falsa
Estado vapor
El término vapor se refiere estrictamente a la sustancia que se puede condensar por presurización a temperatura constante o por enfriamiento a presión constante.
El vapor es el estado en el que se encuentra una sustancia, cuando las moléculas que forman la materia, no reaccionan entre sí formando enlaces moleculares, sino que tienden a repelerse mutuamente, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, proceso de expansión, cuando se encuentra por debajo de su temperatura crítica.
Rpta. : "C"
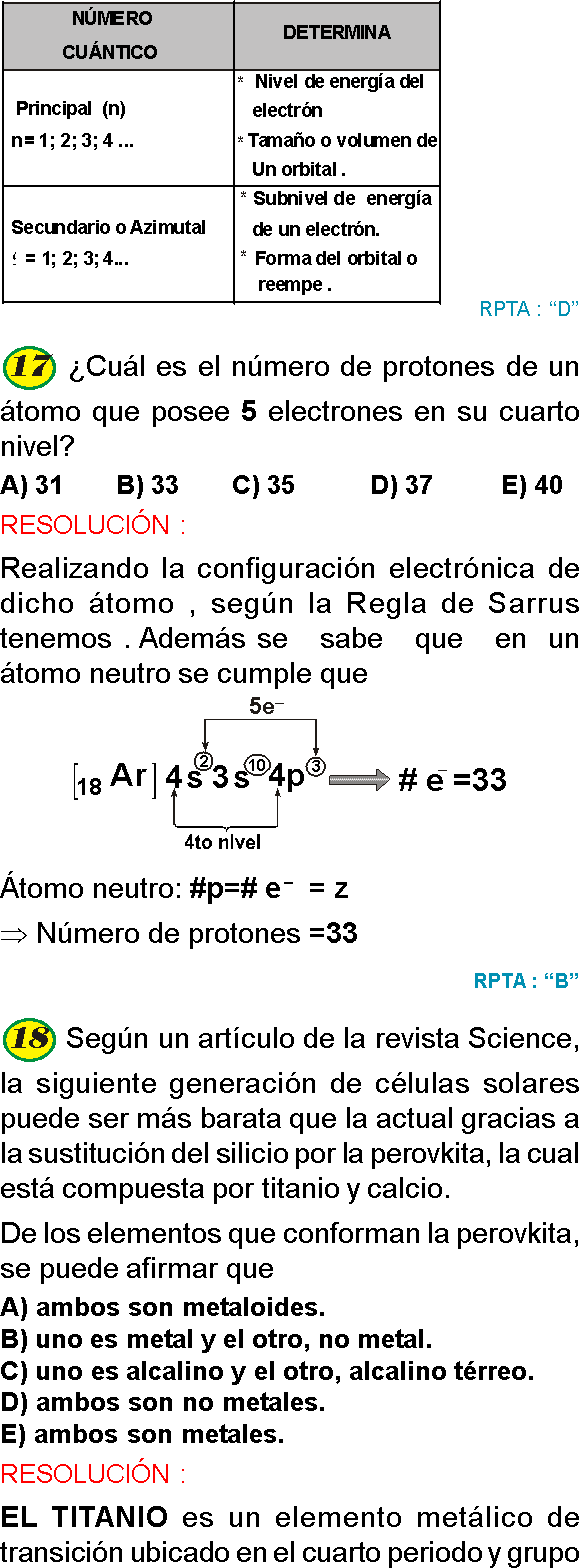
PREGUNTA 16 :
Para la formación de un mol de O₂ la energía de enlace necesaria es de 1,20×10⁵ cal. Determinar la energía necesaria para formar una molécula de O₂
A) 2,01×10−¹⁵ cal
B) 1,90×10¹⁹ cal
C) 1,99×10−¹⁵ cal
D) 1,99×10−¹⁹ cal
E) 2,01×10¹⁹ cal
RESOLUCIÓN :
MOLÉCULA GRAMO, MOL GRAMO O MOL
Concepto tradicional
Es el peso molecular expresado en gramos:
Mol = (M) g
Concepto actual
Es el número de Avogadro en moléculas expresado en gramos.
Mol = (N₀. Moléculas ) g
1 mol de O₂ contiene 6,022×10²³ moléculas
6,022×10²³ moléculas → 1,20×10⁵ cal.
1 molécula → x
⇒ x = 1,99×10−¹⁹ cal
Rpta. : "D"
PREGUNTA 17 :
¿Qué volumen de disolvente debe agregarse a 5 cm³ de disolución de HC1 6 M para obtener una disolución de HC1 0,1 M?
A) 285 cm³
B) 275 cm³
C) 295 cm³
D) 266 cm³
E) 235 cm³
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 18 :
La combustión completa del propano, da como producto: dióxido carbono y agua. ¿Cuántos gramos de propano reaccionan con 10 g de oxígeno?
A) 1,00 g
B) 4,40 g
C) 2,75 g
D) 3,20 g
E) 5,00 g
RESOLUCIÓN :
LEY DE LOUIS JOSEPH PROUST O LEY DE LAS PROPORCIONES DEFINIDAS, CONSTANTES
Cuando dos sustancias reaccionan para formar un nuevo producto, la relación de sus pesos o masas, siempre están en una relación fija, constante o definida.
Rpta. : "C"
PREGUNTA 19 :
Un recipiente cerrado contiene 64 g de O₂ y 224 g de N₂ que ejercen una presión total de 800 mm Hg. Calcular la presión parcial del O₂.
A) 60,0 mm Hg
B) 64,0 mm Hg
C) 160,0 mm Hg
D) 120,0 mm Hg
E) 100,0 mm Hg
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 20 :
En el compuesto Fe₂(Cr₂O₇)₃ el Cr actúa con número de oxidación:
A) 2⁺
B) 3⁺
C) 6⁺
D) 4⁺
E) 2⁻
RESOLUCIÓN :
NÚMERO O ESTADO DE OXIDACIÓN
Es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces con elementos distintos fueran 100 % iónicos.
En los compuestos iónicos es real, y en los compuestos moleculares es carga aparente.
El compuesto es neutro, la suma de las cargas positivas y negativas aportadas por cada elemento debe ser cero
2(+3) + 3.2.x + 3×7×(–2) = 0
⇒x = 6+
Rpta. : "C"
PREGUNTA 21 :
Un balón de 50 L de capacidad contiene O₂ a la temperatura de 27 °C y 2 atm de presión. Calcular la masa de O₂ en el balón.
A) 130,0 g
B) 13,0 g
C) 150,0 g
D) 15,0 g
E) 100,0 g
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 22 :
En la ecuación termoquímica de la síntesis del armoníaco, NH3, por el proceso Haber:
Un aumento de temperatura provocará que:
A) El equilibrio se desplace a la derecha.
B) Aumente la concentración de NH3.
C) Disminuya la concentración de N2 y H2.
D) Aumente la concentración de N2 y H2.
E) Absorba calor el NH3.
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 23 :
El ácido carboxílico es una función oxigenada que presenta el grupo CARBOXILO en su estructura molecular; este a su vez está formado por:
A) 2 grupos hidroxilo
B) 2 grupos carbonilos
C) 1 grupo oxidrilo y 1 grupo acilo
D) 2 grupos oxicarbonilo
E) 1 grupo hidroxilo y 1 grupo carbonilo
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 24 :
Se llama carbono primario al que se encuentra unido a:
A) Dos átomos de carbono
B) Un átomo de carbono
C) Un átomo de hidrógeno
D) Tres átomos de carbono
E) Dos átomos de hidrógeno
RESOLUCIÓN :
TIPOS DE CARBONO
Carbono primario, átomo que está unido a un sólo átomo de carbono mediante un enlace simple, los átomos de hidrógeno unidos a este tipo de carbono se denominan primarios.
Cada átomo de carbono primario tiene tres hidrógenos primarios.
Rpta. : "B"
PREGUNTA 25 :
En la siguiente reacción:
El producto pie se obtiene es el:
A) 2-clorobutano
B) 2-cloro-2-mctilpropano
C) 1 cloro-2-metilpropano
D) Cloruro de isopropilo
E) Cloruro de secpropilo
RESOLUCIÓN :
Alquenos
Reacción de adición de halogenuros de hidrógeno
Cuando se hacen reaccionar los halogenuros de yodo, cloro y bromo en estado gaseoso, con un alqueno en un disolvente inerte, como el tetracloruro de carbono, se producen los halogenuros de alquilo, a través de la reacción de hidrohalogenación. El orden de actividad en esta reacción a los halógenos, es así:
HI > HBr > HCl.
Es posible obtener uno de estos isómeros o ambos. Hacia el año de 1869 Markownikoff con base en estas observaciones, enunció una regla que hoy lleva su nombre y que establece: el átomo de hidrógeno (parte positiva) se adiciona al carbono que tenga el mayor número de átomos de hidrógeno, y el anión del ácido (parte negativa) se adiciona al carbono que tenga el menor número de átomos de hidrógeno.
Rpta. : "B"
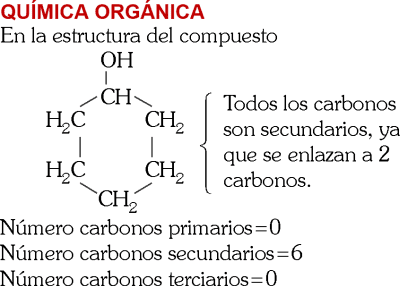
PREGUNTA 26 :
En el siguiente compuesto orgánico:
¿Cuántos carbonos primarios, secundarios y terciarios presenta la estructura?
A) 0, 6 y 0, respectivamente
B) 1, 5 y 0, respectivamente
C) 0, 5 y 1, respectivamente
D) 6, 0 y 0, respectivamente
E) 1, 4 y 1, respectivamente
RESOLUCIÓN :
PREGUNTA 27 :
La reacción química entre una grasa y un hidróxido de sodio se llama reacción de
A) Esterificación
B) Eterificación
C) condensación
D) saponificación
E) sublimación
RESOLUCIÓN :
SAPONIFICACIÓN
Es la reacción de una grasa neutra (sólida, cebo, manteca o líquida) con una base, originando jabón y 1,2,3 propanotriol (glicerol o glicerina).
Esta importante reacción descompone las sustancias grasas cuando se las hierve con una solución de un hidróxido fuerte, como el de sodio o el de potasio (concentración de entre el 22 % y el 24 %).
Estas sales son los jabones.
Las reacciones de saponificación no son reversibles. La palabra saponificar significa producir jabón. Molecularmente es una hidrólisis de los triésteres (grasas neutras) por medio de un álcali fuerte (hidróxido de sodio o de potasio).
A) Incorrecta
La esterificación es una reacción en la cual al menos uno de los productos es un éster, teniendo como catalizador hidrógeno protónico o hidrogenion.
La esterificación de Fischer-Speier o esterificación de Fischer es un tipo especial de esterificación que consiste en la formación de un éster por reflujo de un ácido carboxílico y un alcohol, en presencia de un catalizador ácido.
B) Incorrecta
La eterificación es la formación de éteres y se realiza por síntesis de Williamson; al combinarse alcóxido y halogenuro de alquilo.
C) Incorrecta
En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura ( C=O).
D) correcta
E) Incorrecta
SUBLIMACIÓN Es el paso de un sólido a un gas sin pasar por el estado intermedio líquido, manteniendo la temperatura constante, la sublimación es de dos tipos:
a. Sublimación progresiva
Llamada también sublimación directa, simple, volatilización o Sublimación por ejemplo: el alcanfor, el yodo, el arsénico blanco, el azufre, el fósforo rojo, naftaleno o naftalina, el hielo seco.
b. Sublimación regresiva
Llamada también sublimación indirecta o inversa y en forma incorrecta
deposición o depositación por ejemplo: yodo gaseoso a yodo sólido, formación de la nieve.
Rpta. : "D"